La respuesta global a la crisis de COVID-19 no tiene precedentes y es poco probable que las amenazas crónicas atraigan la misma atención, sin importar cuán grande sea el problema. Pero los científicos están llamando la atención sobre la magnitud de la carga que representa la enfermedad pulmonar obstructiva crónica (EPOC ) para la salud mundial.
Es una enfermedad asociada al tabaquismo (Raherison C., Girodet PO. 2009. EUR. Respir. Rev. Vol 18 : 213-221). La EPOC es la tercera causa principal de muerte en todo el mundo; solo las enfermedades coronarias y los accidentes cerebrovasculares cobran más vidas cada año. Sin embargo, la EPOC, que hace que las vías respiratorias pequeñas se estrechen y el tejido pulmonar se descomponga, aún hay muchas preguntas sin responder.
A continuación destacaremos seis avances científicos sobre esta terrible enfermedad, abriendo nuevas esperanzas para esos pacientes que están agobiados por la búsqueda del oxígeno del aire que «respira».
1. Nuevos factores genéticos descubiertos
Dos artículos de grandes colaboraciones internacionales han revelado factores genéticos que contribuyen a la función pulmonar y la EPOC que iluminan las vías biológicas y los posibles objetivos farmacológicos. Son algunos de los estudios genéticos más grandes de la función pulmonar y la EPOC hasta el momento.
El primero, dirigido por Nick Shrine de la Universidad de Leicester, Reino Unido (Shrine, N et al. 2019. Nature Genet. 51 , páginas 481 – 493) evaluó los marcadores genéticos relacionados con la función pulmonar en un estudio de asociación de todo el genoma de unos 400.000 individuos de ascendencia europea. Los investigadores identificaron 279 regiones genéticas asociadas con la función pulmonar, 139 de las cuales eran nuevas. El equipo demostró que una combinación de estas variantes podría usarse para predecir la EPOC tanto en fumadores como en no fumadores. También encontró que el riesgo para los fumadores podría variar hasta cinco veces.
Los hallazgos destacan la importancia de varias vías biológicas en la EPOC, incluido el desarrollo de cilios. Estas pequeñas estructuras similares a pelos ayudan a eliminar la mucosidad de las vías respiratorias y se sabe que su función se ve afectada en la EPOC. La investigación sugiere que la disfunción de los cilios no es simplemente una consecuencia de la EPOC, sino un impulsor de la enfermedad. El equipo también examinó las asociaciones entre variantes genéticas específicas y una amplia gama de rasgos de la enfermedad, y encontró evidencia de que la EPOC comparte algunos determinantes genéticos con las enfermedades autoinmunes.
El segundo, que analizó específicamente los genomas de las personas con EPOC, fue dirigido por Phuwanat Sakornsakolpat en el Hospital Brigham and Women’s de Boston, Massachusetts (Sakornsakolpat, P. et al. 2019. Nature Genet. 51. 494 – 505). Comparó los datos de unas 36.000 personas con EPOC con los datos de unas 222.000 personas sanas. Los investigadores encontraron 82 regiones asociadas con la EPOC, algunas de las cuales no se habían relacionado previamente con la enfermedad. De estas, 22 regiones nunca se han asociado con la función pulmonar. La identificación de estos loci genéticos adicionales en personas con EPOC sugiere que puede haber factores que afecten el desarrollo de la enfermedad, pero que no afecten de manera medible la función pulmonar.
Estos estudios subrayan la diversidad genética de la EPOC y revelan más factores genéticos que hacen que algunas personas sean más susceptibles a la enfermedad.
 2. Biomarcador de imagen validado en humanos
2. Biomarcador de imagen validado en humanos
Se ha demostrado que una técnica de imágenes no invasiva que puede caracterizar diferentes tipos de patología de la EPOC es precisa cuando se compara con los resultados del análisis de muestras de tejido (Vasilescu, D. Soy. J. Respir. Crit. Care Med . 200 , 575–581 (2019). Estos investigadores han demostrado que la técnica, basada en la tomografía computarizada (TC), puede diferenciar la enfermedad que afecta las vías respiratorias pequeñas del enfisema (daño a los sacos de aire llamados alvéolos). La evidencia sugiere que el daño a las vías respiratorias pequeñas precede al enfisema y podría acumularse durante años antes de que se detecte mediante una prueba de función pulmonar. La nueva técnica podría identificar a las personas con enfermedad en etapa temprana, cuando el tratamiento podría ser el más eficaz.
Las tomografías computarizadas ya pueden detectar alvéolos agrandados que causan enfisema midiendo la densidad del tejido pulmonar cuando los pulmones están llenos. La enfermedad de las vías respiratorias pequeñas también altera la densidad del tejido al atrapar el gas, pero la TC convencional no tiene la resolución suficiente para visualizar estas vías respiratorias, que tienen unos 2 milímetros de diámetro. El nuevo método, llamado mapeo de respuesta paramétrica (PRM), compara las tomografías computarizadas realizadas después de la inspiración y la espiración para calcular los cambios en la densidad del tejido pulmonar que indican una enfermedad de las vías respiratorias pequeñas. El equipo dice que la PRM le permite diferenciar entre los cambios de densidad asociados con el enfisema y los que indican daños en las vías respiratorias pequeñas.
Meilan Han de la Universidad de Michigan, Ann Arbor, dirigió la colaboración de radiólogos y cirujanos para probar la precisión de la técnica en el tejido extraído de los pulmones. El equipo realizó PRM en 11 personas con EPOC grave antes de la cirugía de trasplante de pulmón. Luego, los investigadores utilizaron micro-CT, una tecnología de ultra alta resolución que no se puede usar en personas debido a los rayos X de alta energía, para analizar muestras de tejido pulmonar. Las regiones designadas como enfermedad de las vías respiratorias pequeñas por PRM correspondían a características de esa condición: pérdida, estrechamiento, engrosamiento y obstrucción de los bronquiolos.
Los estudios futuros deberán demostrar que la PRM es precisa en enfermedades más leves. Pero podría usarse para identificar a los fumadores en riesgo de desarrollar EPOC o rastrear el impacto de nuevas terapias en la progresión de la enfermedad.
3. Comienza el ensayo de fase III para terapia nerviosa
Una terapia que altera los nervios de los pulmones ha entrado en ensayos clínicos para probar su eficacia en la prevención de brotes de EPOC (Slebos, D. 2019.Soy. J. Respir. Crit. Care Med . 200 , 1477–1486).
Muchas personas con EPOC tienen períodos de exacerbación de los síntomas, que pueden llevar a la hospitalización. La denervación pulmonar dirigida (TLD) tiene como objetivo reducir los brotes mediante la administración de una corriente eléctrica de radiofrecuencia que interrumpe los nervios del pulmón. La técnica se basa en investigaciones que sugieren que el neurotransmisor acetilcolina causa constricción de las vías respiratorias, exceso de moco e inflamación en la EPOC. El TLD está destinado a producir un efecto más duradero que los inhaladores anticolinérgicos, que administran una sustancia química para bloquear la acción de la acetilcolina, al interrumpir la producción de acetilcolina por los nervios.
En un ensayo de fase II doble ciego controlado con placebo dirigido por Dirk-Jan Slebos de la Universidad de Groningen, Países Bajos, se demostró que la técnica era segura. La mitad de los 82 participantes con EPOC recibieron terapia TLD junto con sus tratamientos existentes. Entre 3 y 6,5 meses después del tratamiento, el 32% de los tratados tuvieron eventos adversos respiratorios, en comparación con el 71% de las personas del grupo placebo. Durante un año, el riesgo de hospitalización también fue mucho menor en el grupo de tratamiento.
Los resultados, como los síntomas informados por los pacientes, no fueron significativamente diferentes, pero un ensayo de fase III, con el objetivo de inscribir a 520 personas, está ahora en marcha y podría resultar más sensible.

4. Las secreciones de células sanguíneas provocan síntomas
En la década de 1980, los investigadores encontraron que las células sanas liberan pequeños paquetes envueltos en membranas que ahora se conocen como exosomas. Se originan en el interior de las células, donde se cargan con cargas que incluyen proteínas específicas y ARN antes de ser liberados para viajar más allá de la célula.
Se ha descubierto que estos exosomas causan el daño al tejido pulmonar que se observa en la EPOC. Un estudio dirigido por Edwin Blalock en la Universidad de Alabama en Birmingham mostró que los exosomas liberados por glóbulos blancos llamados neutrófilos generan patología de la EPOC en los pulmones de ratones sanos (Blalock, E. et al. 2019. Cell. 176, 113 -126).
Los exosomas son secretados por todas las células y participan en la señalización celular o en el transporte de cargas, como las enzimas. Los neutrófilos se activan cuando detectan una infección. Cuando esto sucede, eliminan los exosomas cubiertos por la enzima elastasa de neutrófilos que degrada las proteínas. En los pulmones, esto descompone el colágeno y la elastina en la matriz extracelular, el andamio que sostiene las estructuras similares a uvas conocidas como alvéolos.
Normalmente, los pulmones están protegidos contra este daño por la molécula α1-antitripsina, que inhibe la elastasa de los neutrófilos. Sin embargo, el equipo descubrió que la enzima escapa a esta inhibición cuando se une a un exosoma. Los exosomas también llevan otra proteína de superficie llamada Mac-1 que se une a las fibrillas de colágeno, aumentando la capacidad del exosoma para dañar el tejido. Como resultado, se descubrió que los exosomas de los neutrófilos activados eran 10.000 veces más dañinos que la elastasa de los neutrófilos sola.
El equipo demostró que cuando se recolectaban exosomas de neutrófilos activados del líquido pulmonar de personas con EPOC y se transfirieron a ratones, aumentaron los alvéolos y aumentaron la resistencia de las vías respiratorias. La eliminación de la elastasa de neutrófilos de los exosomas o la inhibición de la enzima o Mac-1 podrían ser tratamientos potenciales.
 5. Avanzan los trasplantes de pulmón de bioingeniería
5. Avanzan los trasplantes de pulmón de bioingeniería
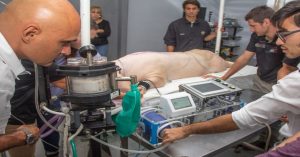
Los pulmones son órganos complejos de diseñar: contienen múltiples tipos de células especializadas en una matriz extracelular con una arquitectura única que debe mantener el cumplimiento durante la respiración. El trasplante de pulmón es una terapia de último recurso para la EPOC en etapa terminal. Pero el suministro de órganos de donantes es limitado y los trasplantes pueden rechazarse. Los pulmones de bioingeniería podrían ofrecer una solución. Un equipo dirigido por Joaquín Cortiella de la Rama Médica de la Universidad de Texas en Galveston ha informado sobre el intento más avanzado hasta ahora de trasplantar pulmones de bioingeniería a cerdos (Nichols, J. et al. 2018. Science Translational Medicine. Vol. 10, Edición 452, eaao3926 DOI: 10.1126 / scitranslmed.aao3926).
Estudios previos han demostrados que el trasplante de pulmones modificados por bioingeniería en ratas provocaba hemorragia, coagulación e hinchazón, por lo que el objetivo principal del equipo era producir una estructura funcional de vasos sanguíneos que pudiera soportar la supervivencia a largo plazo del tejido trasplantado.
En este estudio,los investigadores abordaron los desafíos de la perfusión vascular, la recelularización y el injerto de pulmones modificados con tejidos en un modelo porcino clínicamente relevante. La administración de nanopartículas e hidrogel de factores de crecimiento promovió la adhesión celular a los andamios pulmonares de cerdo descelularizados completos. Los pulmones de bioingeniería sembrados con células autólogas mostraron perfusión vascular a través de la circulación colateral en las 2 semanas posteriores al trasplante. Los pulmones de bioingeniería trasplantados se airearon y desarrollaron microbiomas pulmonares nativos.
Para crear los pulmones, el equipo despojó a los pulmones de los cerdos de las células, dejando la matriz extracelular, antes de repoblar estos ‘andamios’ con células derivadas de los pulmones de los receptores. Luego añadieron plasma y proteínas para desarrollar los pulmones en cultivo durante 30 días.
Una vez trasplantados a los cerdos, los pulmones desarrollaron tejido vascular y circulación sanguínea, así como tejido alveolar. No hubo problemas con el rechazo y los cerdos sobrevivieron hasta dos meses. Los órganos tenían una expresión génica y una función inmunitaria similares a las de los pulmones de los cerdos, y las comunidades de microorganismos nativos se establecieron en los órganos.
Los pulmones no contribuyeron al intercambio de gases, porque la vasculatura diseñada por bioingeniería no estaba vinculada a las arterias del huésped. Sin embargo, este es el tiempo más largo que ha sobrevivido un animal en un estudio de este tipo. Los componentes pulmonares extracelulares están muy conservados entre los cerdos y los humanos, por lo que es posible que los andamios de los cerdos puedan usarse en trasplantes humanos. Este trabajo representa un avance considerable en el campo de la ingeniería de tejidos pulmonares y acerca los pulmones creados por ingeniería de tejidos al ámbito de la posibilidad clínica.
 6. Los corticosteroides alteran el microbioma
6. Los corticosteroides alteran el microbioma
Los pacientes con EPOC tienen una mayor susceptibilidad a infecciones bacterianas que pueden tener consecuencias nocivas sobre el resultado de la enfermedad. Los mecanismos que modulan la susceptibilidad a las infecciones en la EPOC son poco conocidos. Los corticosteroides inhalados (CSI) son el tratamiento estándar para la EPOC. Sin embargo, los corticosteroides inhalados pueden permitir que florezcan las infecciones bacterianas al alterar la comunidad de microorganismos en el pulmón.
Un equipo dirigido por Sebastian Johnston del Instituto Nacional del Corazón y los Pulmones del Imperial College de Londres (Singanayagam. A. 2019. Science Translational Medicine. Vol. 11, Issue 507, eaav3879.DOI: 10.1126/scitranslmed.aav3879) mostró que los esteroides alteran la microbiota pulmonar al inhibir las moléculas antibacterianas, lo que podría explicar estudios previos que indican que los medicamentos aumentan el riesgo de neumonía en personas con EPOC. El equipo analizó muestras de esputo de personas con EPOC para mostrar que los esteroides inhalados están asociados con la microbiota pulmonar alterada y la proliferación de bacterias Streptococcus . Cuando a los ratones se les administraron esteroides, hubo un aumento similar de bacterias.
En modelos de ratones y células humanas, el equipo demostró que los esteroides alteran la eliminación de Streptococcus pneumoniae , la causa bacteriana más común de neumonía, al suprimir el péptido antimicrobiano catelicidina. Los esteroides parecen aumentar la expresión de una proteasa que degrada la catelicidina, llamada catepsina D. El equipo también mostró que la catelicidina revirtió el aumento de la carga bacteriana observada en ratones tratados con esteroides, al igual que la inhibición de la catepsina D. Estas estrategias podrían ser efectivas para prevenir o tratar Complicaciones de la EPOC.
En conclusión, estos datos sugieren un papel central para la catepsina D / catelicidina en la supresión de la defensa antibacteriana del huésped por ICS en la EPOC. La restauración terapéutica de catelicidina para estimular la inmunidad antibacteriana y modular beneficiosamente la microbiota pulmonar podría ser una estrategia eficaz en la EPOC.
