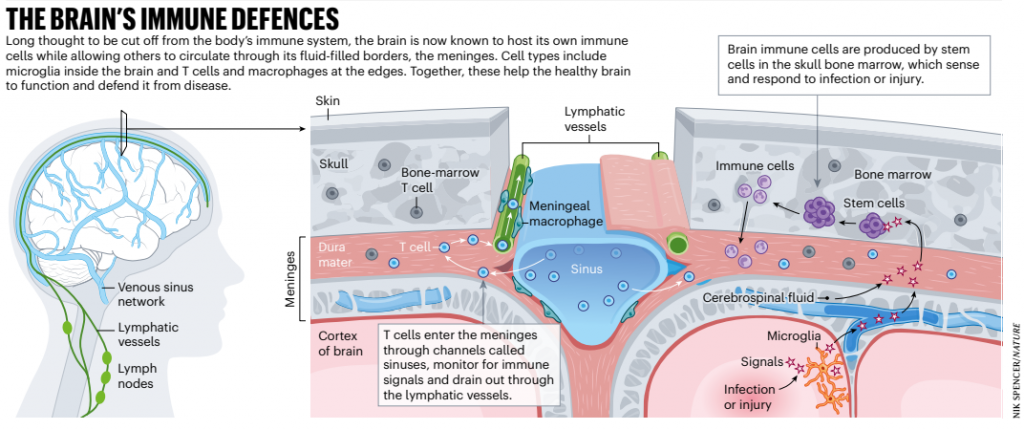
El cerebro es el soberano del cuerpo y recibe protección de acuerdo con su alto estatus. Sus células son longevas y se albergan dentro de una temible fortificación llamada barrera hematoencefálica. Durante mucho tiempo, los científicos pensaron que el cerebro estaba completamente aislado del caos del resto del cuerpo, especialmente de su ansioso sistema de defensa, una masa de células inmunitarias que combaten las infecciones y cuyas acciones podrían amenazar a un gobernante atrapado en el fuego cruzado.
Sin embargo, en la última década, los científicos descubrieron que el trabajo de proteger el cerebro no es tan sencillo como pensaban. Han aprendido que sus fortificaciones tienen puertas y brechas, y que sus fronteras están llenas de células inmunes activas.
Los sistemas nervioso e inmunológico están estrechamente entrelazados. Descifrar su charla podría ayudar a abordar muchos trastornos y enfermedades cerebrales.
Una gran cantidad de evidencia ahora muestra que el cerebro y el sistema inmunológico están estrechamente entrelazados. Los científicos ya sabían que el cerebro tenía sus propias células inmunitarias residentes, llamadas microglia; Los descubrimientos recientes están pintando imágenes más detalladas de sus funciones y revelando las características de los otros guerreros inmunes alojados en las regiones alrededor del cerebro. Algunas de estas células provienen de otras partes del cuerpo; otros se producen localmente, en la médula ósea del cráneo. Al estudiar estas células inmunitarias y trazar un mapa de cómo interactúan con el cerebro, los investigadores están descubriendo que desempeñan un papel importante tanto en los cerebros sanos como en los enfermos o dañados. El interés en el campo se ha disparado: hubo menos de 2000 artículos por año sobre el tema en 2010, aumentando a más de 10 000 por año en 2021,
Los científicos ya no consideran que el cerebro sea una zona especial sellada. “Toda esta idea del privilegio inmunológico está bastante desactualizada ahora”, dice Kiavash Movahedi, neuroinmunólogo de la Universidad Libre de Bruselas (VUB). Aunque el cerebro todavía se considera inmunológicamente único (sus barreras evitan que las células inmunitarias entren y salgan a voluntad), está claro que el cerebro y el sistema inmunitario interactúan constantemente.
Espacio privilegiado
Hace más de dos décadas, cuando la neuroinmunóloga Michal Schwartz acababa de instalar su laboratorio en el Instituto de Ciencias Weizmann en Rehovot, Israel, no podía dejar de hacerse una pregunta impopular: ¿será realmente cierto que el cerebro está completamente cortado? de la protección inmunológica? “Era completamente axiomático que el cerebro no puede tolerar ninguna actividad inmunológica; todos pensaron que si tienes alguna activación inmunológica, esto era un signo de patología”, dice ella. “Pero no tenía sentido que un tejido que es tan indispensable, como el cerebro, no pueda disfrutar del beneficio de ser asistido por el sistema inmunológico”.
 La idea de que el cerebro estaba fuera del alcance del sistema inmunitario se arraigó décadas antes. En la década de 1920, el científico japonés Y. Shirai informó [Shirai, Y. Jap. Med. World 1, 14–15 (1921)] que cuando se implantaban células tumorales en el cuerpo de una rata, la respuesta inmunitaria las destruía, pero cuando se colocaban en el cerebro sobrevivían, lo que indicaba una respuesta inmunitaria débil o ausente. Hallazgos similares siguieron en la década de 1940.
La idea de que el cerebro estaba fuera del alcance del sistema inmunitario se arraigó décadas antes. En la década de 1920, el científico japonés Y. Shirai informó [Shirai, Y. Jap. Med. World 1, 14–15 (1921)] que cuando se implantaban células tumorales en el cuerpo de una rata, la respuesta inmunitaria las destruía, pero cuando se colocaban en el cerebro sobrevivían, lo que indicaba una respuesta inmunitaria débil o ausente. Hallazgos similares siguieron en la década de 1940.
La mayoría de los científicos también pensaron que el cerebro carecía de un sistema para transportar moléculas inmunitarias hacia adentro y hacia afuera, el sistema de drenaje linfático que existe en otras partes del cuerpo, a pesar de que dicho sistema se describió por primera vez en el cerebro hace más de dos siglos [Mascagni, P. Vasorum Lymphaticorum Corporis Humani Historia et Ichnographia (Pazzini Carli, 1787)]. Entonces, la opinión predominante era que el cerebro y el sistema inmunitario vivían en gran medida vidas separadas. Se pensaba que los dos chocaban solo en hostiles: cuando las células inmunitarias se rebelaban y atacaban a las propias células del cuerpo en enfermedades como la esclerosis múltiple.
Entonces, cuando, a fines de la década de 1990, Schwartz y su equipo informaron [Moalem, G. et al. Nature Med. 5, 49–55 (1999)] que después de una lesión aguda en el sistema nervioso central, dos tipos de células inmunitarias, los macrófagos y las células T, protegían a las neuronas del daño y apoyaban su recuperación, muchos científicos se mostraron escépticos. “Todo el mundo me dijo que estaba absolutamente equivocado”, recuerda Schwartz.
Desde esos primeros experimentos, el equipo de Schwartz y otros han acumulado una gran cantidad de evidencia que muestra que las células inmunitarias, de hecho, tienen un papel importante en el cerebro, incluso en ausencia de una enfermedad autoinmune. Los investigadores han demostrado, por ejemplo, que en ratones diseñados para carecer de un sistema inmunitario, las enfermedades neurodegenerativas como la enfermedad de las neuronas motoras (esclerosis lateral amiotrófica) y la enfermedad de Alzheimer parecían progresar más rápidamente [Beers, D. R., Henkel, J. S., Zhao, W., Wang, J. & Appel, S. H. Proc. Natl Acad. Sci. USA 105, 15558–15563 (2008)] , mientras que la restauración del sistema inmunitario ralentizaba su progresión. Los científicos también han revelado un papel potencial para la microglía en la enfermedad de Alzheimer.
Más recientemente, los científicos han demostrado que las células inmunitarias en los bordes del cerebro están activas en las enfermedades neurodegenerativas. Después de examinar el líquido cefalorraquídeo de personas con Alzheimer, Wyss-Coray y sus colegas encontraron evidencia de un aumento en la cantidad de células T en los bordes llenos de líquido del cerebro [Gate, D. et al. Nature 577, 399–404 (2020)]. La expansión de estas poblaciones de células inmunitarias sugiere que podrían tener un papel en la enfermedad, dice Wyss-Coray.
Pero si las células inmunitarias dañan o ayudan al cerebro es una pregunta abierta. En sus estudios sobre el Alzheimer y otros trastornos neurodegenerativos, Wyss-Coray y sus colegas sugieren que el sistema inmunitario podría estar dañando las neuronas al liberar moléculas que aumentan la inflamación y desencadenan la muerte celular. Otros han sugerido que las células TReject All Changes y otras células inmunitarias podrían ser protectoras. Por ejemplo, el grupo de Schwartz ha informado [Baruch, K. et al. Nature Med. 22, 135–137 (2016)] que en modelos de ratones con Alzheimer, el refuerzo de la respuesta inmunitaria conduce a la eliminación de las placas amiloides, un sello patológico de la enfermedad, y mejora el rendimiento cognitivo.
Fronteras ocupadas
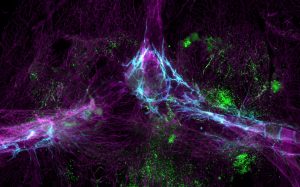
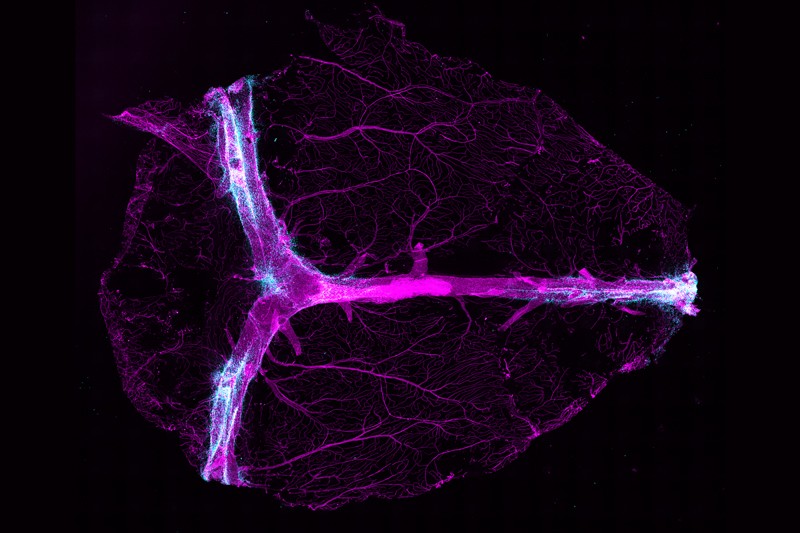
Ahora está quedando claro que los márgenes del cerebro son inmunológicamente diversos: casi cualquier tipo de célula inmune en el cuerpo también se puede encontrar en el área que rodea el cerebro. Las meninges, las membranas llenas de líquido que envuelven el cerebro, son un «país de las maravillas inmunológico», dice Movahedi, cuyo trabajo se centra en los macrófagos en los bordes del cerebro. “Están sucediendo muchas cosas ahí fuera”.
Algunos residentes son exclusivos de las fronteras. En 2021, Jonathan Kipnis, neuroinmunólogo de la Universidad de Washington en St. Louis, Missouri, y sus colegas informaron [Cugurra, A. et al. Science 373, eabf7844 (2021)] que existe una fuente local de células inmunitarias: la médula ósea del cráneo.
Cuando exploraron cómo la médula ósea moviliza estas células, Kipnis y sus colegas demostraron [Mazzitelli, J. A. et al. Nature Neurosci. 25, 555–560 (2022)] que, en respuesta a una lesión en el sistema nervioso central o en presencia de un patógeno, las señales transportadas en el líquido cefalorraquídeo se transmitían a la médula ósea del cráneo. , incitándolo a producir y liberar estas células.
Queda por ver qué papel tienen estas células inmunitarias producidas localmente, pero el grupo de Kipnis cree que podrían tener un papel más suave que las células inmunitarias de otras partes del cuerpo, regulando la respuesta inmunitaria en lugar de estar preparadas para luchar. Kipnis dice que esta distinción, si es cierta, tiene implicaciones para el tratamiento. En enfermedades como la esclerosis múltiple, dice, los síntomas quizás podrían mejorar evitando que entren células inmunitarias de otras partes del cuerpo. Por el contrario, con un tumor cerebral, agrega, «quieres a los combatientes».
Su equipo también ha detectado una red de canales que serpentean y se ramifican sobre la superficie del cerebro, y que pululan con células inmunes, formando el propio sistema linfático del cerebro [Louveau, A. et al. Nature 523, 337–341 (2015)]. Estos vasos, que se encuentran en la parte más externa de las meninges, brindan a las células inmunitarias un punto de vista cerca del cerebro desde donde pueden monitorear cualquier signo de infección o lesión.
En la enfermedad y en la salud
A medida que aumenta la evidencia de la participación de las células inmunitarias durante las lesiones y enfermedades cerebrales, los investigadores han estado explorando su función en cerebros sanos. “Creo que la parte más emocionante de la neuroinmunología es que es relevante para tantos trastornos y condiciones diferentes y para la fisiología normal”, dice Beth Stevens, neurocientífica del Boston Children’s Hospital en Massachusetts.
Muchos grupos, incluido el de Stevens, han descubierto que la microglía es importante para el desarrollo del cerebro. Estas células están involucradas en la poda de las conexiones neuronales y los estudios sugieren que los problemas en el proceso de poda podrían contribuir a las condiciones del neurodesarrollo.
También se ha demostrado que las células inmunitarias fronterizas son esenciales en cerebros sanos. Kipnis, Schwartz y sus colegas, por ejemplo, han demostrado que los ratones que carecen de algunas de estas células muestran problemas de aprendizaje y comportamiento social [Filiano, A. J. et al. Nature 535, 425–429 (2016)]. Otros informaron [Pasciuto, E. et al. Cell 182, 625–640 (2020)] en 2020 que los ratones que se desarrollan sin una población específica de células T tanto en el cerebro como en el resto del cuerpo tienen microglía defectuosa. Su microglía lucha por eliminar las conexiones neuronales durante el desarrollo, lo que genera un número excesivo de sinapsis y un comportamiento anormal. Los autores proponen que durante este período crucial, las células T migran al cerebro y ayudan a la microglía a madurar.
Un gran misterio es cómo exactamente las células inmunitarias, en particular las que se encuentran alrededor de los bordes, se comunican con el cerebro. Aunque hay alguna evidencia de que ocasionalmente pueden cruzar al órgano, la mayoría de los estudios hasta ahora sugieren que estas células se comunican mediante el envío de mensajeros moleculares conocidos como citocinas. Estos, a su vez, influyen en el comportamiento.
Los investigadores han estado estudiando cómo las citocinas afectan el comportamiento durante décadas y descubrieron, por ejemplo, que las citocinas enviadas por las células inmunitarias durante la infección pueden iniciar «comportamientos de enfermedad», como el aumento del sueño [Krueger, J. M., Walter, J., Dinarello, C. A., Wolff, S. M. & Chedid, L. Am. J. Physiol. 246, R994–R999 (1984)]. También han demostrado en modelos animales que las alteraciones en las citoquinas, inducidas por su agotamiento en todo el cuerpo o por la eliminación de receptores específicos de citoquinas en las neuronas, pueden provocar alteraciones en la memoria, el aprendizaje y las conductas sociales [Salvador, A. F., de Lima, K. A. & Kipnis, J. Nature Rev. Immunol. 21, 526–541 (2021)]. La forma en que las citoquinas viajan al cerebro y ejercen sus efectos sigue siendo un área de estudio activo.
Las citoquinas también podrían ser un vínculo entre el sistema inmunitario y las condiciones del neurodesarrollo, como el autismo . Cuando Gloria Choi, neuroinmunóloga del Instituto Tecnológico de Massachusetts en Cambridge, y sus colegas aumentaron los niveles de citocinas en ratones preñados, observaron cambios cerebrales y comportamientos similares al autismo en las crías [Choi, G. B. et al. Science 351, 933–939 (2016)].
Aunque estas ideas son tentadoras, gran parte del trabajo sobre cómo las células inmunitarias, especialmente las de los bordes, operan en el cerebro aún está en pañales. “Estamos muy lejos de comprender lo que sucede en los cerebros sanos”, dice Kipnis.
Una calle de doble sentido
La comunicación entre el sistema inmunitario y el cerebro también parece ir en la otra dirección: el cerebro puede dirigir al sistema inmunitario.
Algunas de estas ideas tienen décadas de antigüedad. En la década de 1970, los científicos condicionaron a ratas para que se inmunodeprimieran cuando probaban la sacarina, un edulcorante artificial, combinándola con un fármaco inmunosupresor durante varios días [Ader, R. & Cohen, N. Psychosom. Med. 37, 333–340 (1975)].
En un trabajo más reciente, Asya Rolls, neuroinmunóloga del Technion, Instituto de Tecnología de Israel en Haifa, y su equipo exploraron el vínculo entre la emoción, la inmunidad y el cáncer en ratones. Informaron [Ben-Shaanan, T. L. et al. Nature Commun. 9, 2723 (2018)] en 2018 que la activación de las neuronas en el área tegmental ventral, una región del cerebro involucrada en las emociones positivas y la motivación, impulsó la respuesta inmune y, a su vez, ralentizó el crecimiento del tumor.
Luego, en 2021, su grupo identificó neuronas en la corteza insular, una parte del cerebro involucrada en el procesamiento de emociones y sensaciones corporales, entre otras cosas, que estaban activas durante la inflamación en el colon, una condición también conocida como colitis.
Al activar estas neuronas artificialmente, los investigadores pudieron despertar la respuesta inmune intestinal [Koren, T. et al. Cell 184, 5902–5915 (2021)]. Así como los perros de Pavlov aprendieron a asociar el sonido de una campana con la comida, haciendo que los animales salivaran cada vez que escuchaban el ruido, las neuronas de estos roedores habían capturado un «recuerdo» de la respuesta inmunológica que podía reiniciarse. “Esto demostró que existe una diafonía muy intensa entre las neuronas y las células inmunitarias”, dice Movahedi, que no participó en este trabajo.
Rolls sospecha que los organismos desarrollaron tales «recuerdos» inmunológicos porque son ventajosos, ya que preparan el sistema inmunológico en situaciones en las que el cuerpo podría encontrarse con patógenos. Ella agrega que, en ciertos casos, pueden ser desadaptativos, cuando el cuerpo anticipa una infección y genera una respuesta inmune innecesaria, causando daños colaterales. Esta vía podría ayudar a explicar cómo los estados psicológicos pueden influir en la respuesta inmune, proporcionando un mecanismo potencial para muchos trastornos psicosomáticos, según Rolls.
También podría inspirar terapias. Rolls y su equipo encontraron que bloquear la actividad de esas neuronas asociadas con la inflamación disminuyó la inflamación en ratones con colitis. Su grupo espera traducir estos hallazgos a los humanos y está examinando si la inhibición de la actividad mediante estimulación cerebral no invasiva puede ayudar a aliviar los síntomas en personas con enfermedad de Crohn y psoriasis, trastornos mediados por el sistema inmunitario. Este trabajo está en las primeras fases, dice Rolls, «pero será genial si funciona».
Otros grupos están explorando cómo el cerebro controla el sistema inmunológico. El equipo de Choi está rastreando las neuronas y los circuitos específicos que modulan la respuesta inmunitaria. Algún día, espera poder generar un mapa completo de las interacciones entre el cerebro y el sistema inmunitario, delineando las células, los circuitos y los mensajeros moleculares responsables de la comunicación en ambas direcciones, y conectándolos con lecturas conductuales o fisiológicas.
Uno de los mayores desafíos ahora es descifrar qué poblaciones de células están involucradas en esta miríada de funciones. Para abordarlo, algunos investigadores han estado investigando cómo estas células difieren a nivel molecular, mediante la secuenciación de genes en células individuales. Esto ha revelado un subconjunto de microglia asociado con enfermedades neurodegenerativas, por ejemplo. Comprender cómo estas microglías funcionan de manera diferente a sus contrapartes sanas será útil para desarrollar tratamientos, dice Stevens. También podrían usarse como marcadores para rastrear la progresión de una enfermedad o la eficacia de las terapias, agrega.
Los investigadores ya han comenzado a utilizar estos conocimientos sobre el ecosistema inmunitario dentro y alrededor del cerebro. El equipo de Schwartz, por ejemplo, está rejuveneciendo el sistema inmunológico con la esperanza de combatir la enfermedad de Alzheimer. Este trabajo ha abierto nuevas vías para la terapia, en particular para las enfermedades neurodegenerativas, dice Schwartz. “Es un momento emocionante en la historia de la investigación del cerebro”.
Articulo publicado en Nature 606 , 22-24 (2022)
doi: https://doi.org/10.1038/d41586-022-01502-8
