 Tal como lo mencionamos en el capítulo I de esta serie, la misma fue creada para poder dar información actualizada de las secuelas que duran meses en pacientes que han sido dados de alta por la infección del SARS-CoV-2. Cada capítulo se tratará sobre la epidemiología, fisiopatología y posibles tratamientos para un grupo determinado de órganos afectados por el virus. En este segundo capitulo hablaremos de las secuelas del sistema pulmonar.
Tal como lo mencionamos en el capítulo I de esta serie, la misma fue creada para poder dar información actualizada de las secuelas que duran meses en pacientes que han sido dados de alta por la infección del SARS-CoV-2. Cada capítulo se tratará sobre la epidemiología, fisiopatología y posibles tratamientos para un grupo determinado de órganos afectados por el virus. En este segundo capitulo hablaremos de las secuelas del sistema pulmonar.
Epidemiología y manifestaciones clínicas.
Entre los supervivientes de COVID-19 se ha informado de un espectro de manifestaciones pulmonares, que van desde disnea (con o sin dependencia crónica de oxígeno) hasta destete difícil del ventilador y daño pulmonar fibrótico. Al igual que los supervivientes del síndrome de dificultad respiratoria aguda (SDRA) de otras etiologías, la disnea es el síntoma persistente más común más allá del COVID-19 agudo, con una prevalencia del 42-66 % a los 60-100 días de seguimiento (Carfi, A., et al. J. Am. Med. Assoc. 324, 603–605. 2020; Chopra, V. et al. Ann. Intern. Med. https://doi.org/10.7326/M20-5661.2020; Garrigues, E. et al. J. Infect. 81, e4–e6, 2020).
En un estudio chino COVID-19 post-aguda, la mediana de la distancia de caminata de 6 minutos fue más baja que los valores de referencia normales en aproximadamente una cuarta parte de los pacientes a los 6 meses (Huang, C. et al. Lancet 397, 220–232, 2021), una prevalencia similar a la de los sobrevivientes de SARS y MERS (Ahmed, H. et al. J. Rehabil. Med. 52, jrm00063, 2020). La necesidad de oxígeno suplementario debido a la hipoxemia persistente, o la nueva necesidad de presión positiva continua en las vías respiratorias u otro soporte respiratorio mientras duerme, se informó en el 6,6 y el 6,9 % de los pacientes, respectivamente, a los 60 días de seguimiento en la fase posaguda en un estudio de EE . UU. (Chopra, V. et al. Ann. Intern. Med. https://doi.org/10.7326/M20-5661.2020).
De los 1.800 pacientes que requirieron traqueostomías durante el COVID-19 agudo, solo el 52 % fueron retirados con éxito de la ventilación mecánica un mes después en un estudio de cohorte nacional de España (Martin-Villares, C. et al. Eur. Arch. Oto Rhino Laryngol. https://doi.org/10.1007/s00405-020-06220-3,2020). Una reducción en la capacidad de difusión es el deterioro fisiológico más comúnmente informado en la COVID-19 posaguda, con una disminución significativa directamente relacionada con la gravedad de la enfermedad aguda (Huang, C. et al. Lancet 397, 220–232, 2021; Huang, Y. et al. Respir. Res. 21, 163, 2020; Mo, X. et al. Eur. Respir. J. 55, 2001217, 2020; Zhao, Y. M. et al. EClinicalMedicine 25, 100463, 2020), lo cual es consistente con estudios de sobrevivientes de SARS y MERS (Ahmed, H. et al. J. Rehabil. Med. 52, jrm00063, 2020), sobrevivientes de influenza H1N1 leve (Liu, W. et al. PLoS ONE 10, e0133698, 2015) y sobrevivientes históricos de ARDS (Herridge, M. S. et al. N. Engl. J. Med. 364, 1293–1304, 2011). Aunque es menos común, se ha encontrado que los sobrevivientes de COVID-19 hospitalizados tienen una fisiología pulmonar restrictiva a los 3 y 6 meses (Huang, C. et al. Lancet 397, 220–232, 2021; Shah, A. S. et al. Thorax https://doi.org/10.1136/thoraxjnl-2020-216308, 2020), lo que también se ha observado en poblaciones históricas de sobrevivientes de ARDS (Herridge, M. S. et al. N. Engl. J. Med. 364, 1293–1304, 2011; Burnham, E. L. et al. Crit. Care Med. 41, 445–456, 2013).
Aproximadamente el 50 % de los 349 pacientes que se sometieron a una tomografía computarizada de alta resolución del tórax a los 6 meses tenían al menos un patrón anormal en el estudio chino COVID-19 post-aguda (Huang, C. et al. Lancet 397, 220–232, 2021). La mayoría de las anomalías observadas por tomografía computarizada fueron opacidades en vidrio esmerilado. Este estudio no investigó la embolia pulmonar crónica ya que no se obtuvieron angiogramas pulmonares por tomografía computarizada. En este momento se desconocen los riesgos a largo plazo de embolia pulmonar crónica y la consiguiente hipertensión pulmonar. Se observaron cambios fibróticos en la tomografía computarizada del tórax, que consisten principalmente en reticulaciones o bronquiectasias por tracción, 3 meses después del alta hospitalaria aproximadamente el 25 y el 65 % de los supervivientes en estudios de cohorte de casos leves a moderados (Zhao, Y. M. et al. EClinicalMedicine 25, 100463, 2020) y casos en su mayoría graves (Shah, A. S. et al. Thorax https://doi.org/10.1136/thoraxjnl-2020-216308, 2020), respectivamente, que se distinguen por la necesidad de oxígeno suplementario. Sin embargo, estas estimaciones de prevalencia deben considerarse preliminares dado el tamaño de la muestra de cada una de estas cohortes. Las estimaciones de prevalencia de las secuelas de COVID-19 posaguda de estos estudios sugieren que los pacientes con mayor gravedad de COVID-19 agudo (especialmente aquellos que requieren una cánula nasal de alto flujo y ventilación mecánica no invasiva o invasiva) tienen el mayor riesgo de Complicaciones pulmonares a largo plazo, que incluyen deterioro persistente de la difusión y anomalías pulmonares radiográficas (como fibrosis pulmonar) (Huang, C. et al. Lancet 397, 220–232, 2021; Arnold, D. T. et al. Thorax https://doi.org/10.1136/thoraxjnl-2020-216086 , 2020).
Patología y fisiopatología
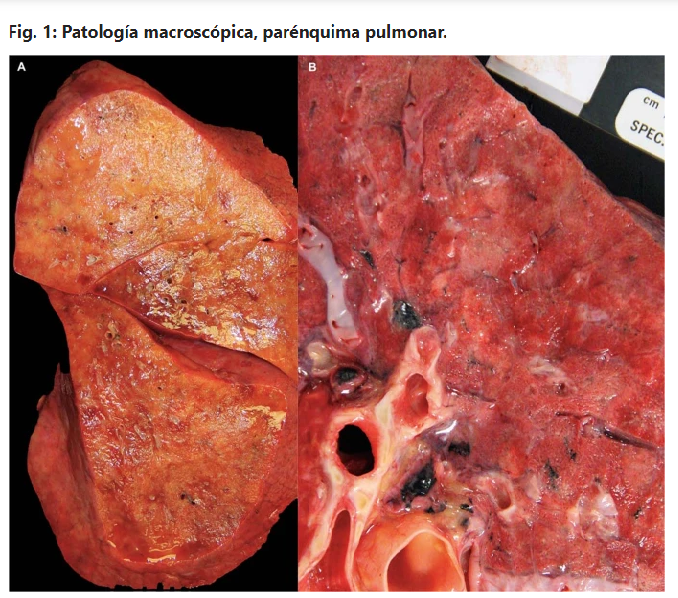
Los mecanismos virales dependientes (incluida la invasión de células endoteliales y epiteliales alveolares por el SARS-CoV-2) y los mecanismos virales independientes (como el daño inmunológico, incluida la inflamación perivascular) contribuyen a la ruptura de la barrera endotelial-epitelial con invasión de monocitos y neutrófilos y extravasación de un exudado rico en proteínas en el espacio alveolar, compatible con otras formas de SDRA (Huppert, L. A., et al. Semin. Respir. Crit. Care Med. 40, 31–39, 2019). Todas las fases de daño alveolar difuso se han informado en series de autopsias de COVID-19, con daño alveolar difuso fibroproliferativo focal y organizativo observado más adelante en el curso de la enfermedad (Carsana, L. et al. Lancet Infect. Dis. 20, 1135–1140, 2020; Schaller, T. et al. J. Am. Med. Assoc. 323, 2518–2520, 2020), consistente con otras etiologías de SDRA (Burnham, E. L., et al. Eur. Respir. J. 43, 276–285, 2014). También se han observado áreas raras de proliferación de miofibroblastos, fibrosis mural y formación de panales microquísticos. Este estado fibrótico puede ser provocado por citocinas como la interleucina-6 (IL-6) y el factor de crecimiento transformante-β, que han sido implicados en el desarrollo de fibrosis pulmonar (McElvaney, O. J. et al. Am. J. Respir. Crit. Care Med. 202, 812–821, 2020; Coker, R. K. et al. Thorax 56, 549–556, 2001) y pueden predisponer a la colonización bacteriana y posterior infección (Hendaus, M. A. & Jomha, F. A. J. Biomol. Struct. Dyn. https://doi.org/10.1080/07391102.2020.1772110 , 2020; Hendaus, M. A., et al. Ther. Clin. Risk Manag. 11, 1265–1271, 2015). El análisis de tejido pulmonar de cinco casos con neumonía grave asociada a COVID-19, incluidas dos muestras de autopsia y tres muestras de pulmones explantados de receptores de trasplante de pulmón, mostró patrones de expresión histopatológicos y unicelulares de ARN similares a la fibrosis pulmonar en etapa terminal sin Infección por SARS-CoV-2, lo que sugiere que algunos individuos desarrollan fibrosis pulmonar acelerada después de la resolución de la infección activa (Bharat, A. et al. Sci. Transl. Med. 12, eabe4282, 2020).
Finalmente, se han observado microtrombosis y macrotrombosis vasculares pulmonares en el 20-30 % de los pacientes con COVID-19 (Cui, S., et al. J. Thromb. Haemost. 18, 1421–1424, 2020; Middeldorp, S. et al. J. Thromb. Haemost. 18, 1995–2002 (2020); Poissy, J. et al. Circulation 142, 184–186, 2020), que es mayor que en otras poblaciones de pacientes críticos (1-10 %) (Corrigan, D., et al. Clin. Exp. Emerg. Med. 3, 117–125, 2016; Lim, W. et al. Crit. Care Med. 43, 401–410, 2015). Además, la gravedad de la lesión endotelial y la trombosis generalizada con microangiopatía observada en la autopsia pulmonar es mayor que la observada en el SDRA por influenza (Ackermann, M. et al. N. Engl. J. Med. 383, 120–128, 2020; Lang, M. et al. Lancet Infect. Dis. 20, 1365–1366, 2020).
Consideraciones de manejo
La atención después del alta hospitalaria de los sobrevivientes de COVID-19 ha sido reconocida como una de las principales prioridades de investigación por parte de organizaciones profesionales, y la orientación para el manejo de estos pacientes aún está evolucionando (Shah, W., et al. Brit. Med. J. 372, n136, 2021). Se ha sugerido que la oximetría de pulso domiciliaria con dispositivos aprobados por la Administración de Alimentos y Medicamentos es una herramienta útil para monitorear a los pacientes con síntomas persistentes; sin embargo, actualmente se carece de evidencia de apoyo (Luks, A. M. & Swenson, E. R. Ann. Am. Thorac. Soc. 17, 1040–1046, 2020; Brigham, E. et al. Am. J. Med. https://doi.org/10.1016/j.amjmed.2020.12.009 , 2021). Algunos expertos también han propuesto la evaluación con PFT seriadas y 6MWT para aquellos con disnea persistente, así como tomografía computarizada de alta resolución de tórax a los 6 y 12 meses (Raghu, G. & Wilson, K. C. Lancet Respir. Med. 8, 839–842, 2020).
En un documento de orientación adoptado por la British Thoracic Society, los algoritmos para evaluar a los sobrevivientes de COVID-19 en los primeros 3 meses después del alta hospitalaria se basan en la gravedad de la COVID-19 aguda y si el paciente recibió o no atención en la UCI (George, P. M. et al. Thorax 75, 1009–1016, 2020). Los algoritmos para los grupos de COVID-19 grave y leve a moderado recomiendan la evaluación clínica y la radiografía de tórax en todos los pacientes a las 12 semanas, junto con la consideración de PFT, 6MWT, muestreo de esputo y ecocardiograma de acuerdo con el juicio clínico. Con base en esta evaluación de 12 semanas, se recomienda que los pacientes sean evaluados con tomografía computarizada de alta resolución del tórax, angiografía pulmonar por tomografía computarizada o ecocardiograma, o que sean dados de alta del seguimiento. Además de esta evaluación de 12 semanas, también se recomienda una evaluación clínica más temprana de las secuelas respiratorias, psiquiátricas y tromboembólicas, así como de las necesidades de rehabilitación, a las 4-6 semanas después del alta para aquellos con COVID-19 aguda severa, definido como aquellos que tuvo neumonía grave, requirió atención en UCI, es anciano o tiene múltiples comorbilidades.
El tratamiento con corticosteroides puede ser beneficioso en un subconjunto de pacientes con enfermedad pulmonar inflamatoria posterior a COVID, como sugiere una observación preliminar de una mejoría sintomática y radiológica significativa en una pequeña cohorte del Reino Unido de sobrevivientes de COVID-19 con neumonía organizada a las 6 semanas después del alta hospitalaria (Myall, K. J. et al. Ann. Am. Thorac. Soc. https://doi.org/10.1513/AnnalsATS.202008-1002OC , 2021). El uso de esteroides durante la fase aguda de COVID-19 no se asoció con alteraciones de la difusión ni anomalías radiográficas a los 6 meses de seguimiento en el estudio chino de COVID-19 posaguda (Huang, C. et al. Lancet 397, 220–232, 2021). El trasplante de pulmón previamente se ha realizado para la enfermedad pulmonar fibroproliferativa después de SDRA (Chang, Y. et al. Transplantation 102, 829–837, 2018), debido a la gripe A (H1N1), la infección (Wang, Q. et al. Ann. Thorac. Surg. 108, e233–e235, 2019) y COVID-19 (Bharat, A. et al. Sci. Transl. Med. 12, eabe4282, 2020). Se están realizando ensayos clínicos de terapias antifibróticas para prevenir la fibrosis pulmonar después de COVID-19 (George, P. M., et al Lancet Respir. Med. 8, 807–815, 2020).
