 A pesar del desarrollo de múltiples vacunas exitosas contra el coronavirus SARS-CoV-2, la continua aparición de variantes preocupantes y la distribución mundial esporádica de vacunas han limitado y seguirán limitando la efectividad de la vacuna. Adicionalmente, surgió un obstáculo en el esfuerzo mundial de las vacunas, el cual ha sido la aparición de eventos raros como la trombosis y el síndrome de trombocitopenia asociados con las vacunas basadas en adenovirus. Esto provocó el cese de la distribución de la vacuna ChAdOx1 nCoV-19 (ChAd) de AstraZeneca en muchos países, así como un aumento en la vacilación por la vacuna en poblaciones con aversión al riesgo [Wise, J. Br. Medicina. J. 372 , n. 699 (2021)]. Finalmente, el retraso de la aplicación de las 2dosis de ciertas vacunas, como la rusa (Sputnik V) que está ocurriendo en diversos países, particularmente en Venezuela, por problemas de producción, ha surgido la idea de combinar diferentes vacunas para poder garantizar la inmunidad en la población contra coronavirus.
A pesar del desarrollo de múltiples vacunas exitosas contra el coronavirus SARS-CoV-2, la continua aparición de variantes preocupantes y la distribución mundial esporádica de vacunas han limitado y seguirán limitando la efectividad de la vacuna. Adicionalmente, surgió un obstáculo en el esfuerzo mundial de las vacunas, el cual ha sido la aparición de eventos raros como la trombosis y el síndrome de trombocitopenia asociados con las vacunas basadas en adenovirus. Esto provocó el cese de la distribución de la vacuna ChAdOx1 nCoV-19 (ChAd) de AstraZeneca en muchos países, así como un aumento en la vacilación por la vacuna en poblaciones con aversión al riesgo [Wise, J. Br. Medicina. J. 372 , n. 699 (2021)]. Finalmente, el retraso de la aplicación de las 2dosis de ciertas vacunas, como la rusa (Sputnik V) que está ocurriendo en diversos países, particularmente en Venezuela, por problemas de producción, ha surgido la idea de combinar diferentes vacunas para poder garantizar la inmunidad en la población contra coronavirus.
Ante ese escenario, la OMS, en julio pasado declaró que no hay suficiente información sobre los beneficios de mezclar o combinar vacunas, y aseguró que se trata de una técnica que podría ser peligrosa y cuya decisión debe ser tomada por expertos (https://www.france24.com/es/programas/ciencia-y-tecnolog%C3%ADa/20210721-mezcla-vacunas-covid19-oms-alerta). Sin embargo, la ciencia y la investigación necesaria para dar respuesta a esta angustiante incertidumbre comenzó a obtener resultados esperanzadores.
 Efectivamente, los estudios de Barros-Martins et al. [Barros-Martins, J. et al. Nat. Medicine. https://doi.org/10.1038/s41591-021-01449-9 (2021)] y Schmidt et al. [Schmidt, T. et al. Nat. Med . https://doi.org/10.1038/s41591-021-01464-w (2021)] capitalizan la vacunación ad hoc heteróloga en la dosis de refuerzo que resultó de la suspensión de la vacunación con ChAd en varios países europeos, lo que dejó a las personas parcialmente vacunadas la opción de completar sus vacunas con una vacuna de ARNm (BNT162b2 (BNT), de Pfizer – BioNTech); o ARNm-1273, de Moderna).
Efectivamente, los estudios de Barros-Martins et al. [Barros-Martins, J. et al. Nat. Medicine. https://doi.org/10.1038/s41591-021-01449-9 (2021)] y Schmidt et al. [Schmidt, T. et al. Nat. Med . https://doi.org/10.1038/s41591-021-01464-w (2021)] capitalizan la vacunación ad hoc heteróloga en la dosis de refuerzo que resultó de la suspensión de la vacunación con ChAd en varios países europeos, lo que dejó a las personas parcialmente vacunadas la opción de completar sus vacunas con una vacuna de ARNm (BNT162b2 (BNT), de Pfizer – BioNTech); o ARNm-1273, de Moderna).
Barros-Martins y col. informan que, en comparación con los resultados obtenidos con la dosificación homóloga de ChAd-ChAd, la estrategia de dosificación de ChAd-BNT dio como resultado respuestas inmunes de inmunoglobulina G (IgG) e IgA significativamente mayores dirigidas contra la proteína pico del SARS-CoV-2 y robustos títulos, de 20 a 60 veces mayores de anticuerpos neutralizantes contra las variantes de interés Alfa (B.1.1.7), Beta (B.1.351) y Gamma (P.1) del SARS-CoV-2 [Barros-Martins, J. et al. Nat. Medicine. https://doi.org/10.1038/s41591-021-01449-9 (2021)]. Estos títulos neutralizantes fueron aproximadamente tres veces más altos que los del suero de los grupos a los que se les administró BNT-BNT (aunque con diferentes intervalos entre la dosis 1 y la dosis 2), con títulos más altos de las subclases IgG e IgA.
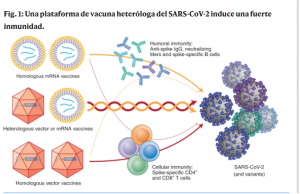
Del mismo modo, Schmidt et al. muestran títulos significativamente más altos de anticuerpos IgG dirigidos contra la proteína pico del SARS-CoV-2 y el dominio de unión al receptor después de la vacunación con ChAd-mRNA (ya sea BNT162b2 o mRNA-1273) o mRNA-mRNA que después de la vacuna homóloga ChAd-ChAd [Schmidt, T. et al. Nat. Med . https://doi.org/10.1038/s41591-021-01464-w (2021)] Además, los participantes a los que se les administró ChAd-ARNm demuestran un mayor número de células T CD4 + y CD8 + específicos de proteína de pico circulantes , así como células T productoras de citocinas, que las de los participantes a los que se les administró la dosis de ChAd-ChAd. Schmidt y col. demuestran además, que se producen respuestas multifuncionales de células T CD4 + específicas de la proteína espiga comparables, pero mayores respuestas de las células T CD8 + en el grupo ChAd-ARNm al del grupo ChAd-ChAd. Un tercer estudio, publicado recientemente en Lance , proporciona evidencia adicional de que el enfoque de la vacuna heteróloga ChAd-mRNA es bien tolerado y estimula una sólida respuesta de IgG y anticuerpos neutralizantes [Borobia, AM y col. Lancet 398 , 121-130 (2021)]. Combinados, estos estudios muestran mejores resultados de inmunogenicidad con dosis heterólogas y sugieren una posible superioridad de esta estrategia sobre los regímenes homólogos de primo-refuerzo para las respuestas celulares y la neutralización de variantes (Figura 1 ).
Como lo indican estos nuevos estudios, la validación de la inmunogenicidad y reactogenicidad de la dosificación de ‘mezclar y combinar’ con diferentes vacunas aprobadas puede ofrecer una solución que podría ayudar a mitigar la escasez e interrupciones del suministro. Los resultados de inmunogenicidad mejorados también sugieren que un enfoque de vacuna heteróloga puede superar las limitaciones de las plataformas de vacuna individuales. La inmunogenicidad en respuesta a las vacunas vectorizadas por adenovirus está limitada por los anticuerpos neutralizantes preexistentes contra los serotipos de adenovirus comunes a los que están expuestos los seres humanos, y puede comprometer la capacidad de generar una respuesta inmune a la proteína de pico del SARS-CoV-2, como se señaló en formulación de vectores de adenovirus de tipo 5 de CanSino Biologics – Instituto de Biotecnología de Beijing [Zhu, F. y col. Lancet 396, 479–488 (2020)]. El uso de un vector adenoviral no humano, como la vacuna ChAd de Astra Zeneca, o el uso de serotipos de adenovirus recombinantes heterólogos (rAd26 seguido de rAd5), como se observa en la vacuna rusa Gamaleya Sputnik V [Logunov, DY et al. Lancet 396 , 887–897 (2020)], permite que las plataformas de vacunas basadas en adenovirus administren el SARS -Proteína de pico CoV-2 de una manera que generará una respuesta inmune mejorada.
La incorporación de vacunas que provocan principalmente respuestas humorales (p. Ej., Vacunas a base de proteínas) y aquellas que provocan fuertes respuestas celulares (p. Ej., Vacunas basadas en vectores virales) en plataformas heterólogas de cebado-refuerzo puede, por lo tanto, mejorar la amplitud de la inmunidad al SARS-CoV-2 [Kardani, K., Bolhassani, A. y Shahbazi, S. Vaccine 34 , 413–423 (2016)]. Los estudios en animales sugieren que la vacunación heteróloga contra el SARS-CoV-2 mejora las respuestas de las células T auxiliares tipo 1 específicas de la proteína de pico, así como los niveles de anticuerpos IgA específicos de la proteína de pico [Spencer, AJ y col. Nat. Comun. 12 , 2893 (2021)]. Cada vez hay más pruebas que demuestran que un cebado vectorizado por adenovirus seguido de un refuerzo de ARNm en un intervalo de 6 a 12 semanas es seguro y proporciona una mayor respuesta inmunitaria humoral y celular que la estrategia de dosis homóloga de ChAd-ChAd. Se están realizando estudios en el Reino Unido, y más recientemente en los EE. UU., Para investigar la estrategia de «mezclar y combinar» de manera prospectiva. Estas estrategias de vacunas heterólogas pueden agregar una mayor resistencia a las vacunas contra el SARS-CoV-2 en el contexto de variantes que surgen continuamente.
En conclusión, aunque desencadenadas por la desafortunada interrupción en el uso de vacunas basadas en adenovirus, las estrategias de dosificación mixta multiplataforma han demostrado resultados de inmunogenicidad ventajosos, medidos tanto por las respuestas humorales como por las respuestas celulares al SARS-CoV-2 original y sus variantes. Estos programas innovadores de dosificación de vacunas pueden ser necesarios tanto como prueba contra las interrupciones del suministro de vacunas como para maximizar las respuestas inmunitarias, lo que a su vez ayudará a reducir la transmisión de variantes emergentes y protegerá a las personas inmunodeprimidas.
