 Un grupo de científicos ha creado por primera vez modelos de embriones similares a los humanos en un laboratorio a partir de células madre y células extraídas de la piel. Se trata de un importante avance que resuelve un problema para los investigadores porque existen muy pocos embriones humanos para estudiarlos y facilita avanzar en la embriología.
Un grupo de científicos ha creado por primera vez modelos de embriones similares a los humanos en un laboratorio a partir de células madre y células extraídas de la piel. Se trata de un importante avance que resuelve un problema para los investigadores porque existen muy pocos embriones humanos para estudiarlos y facilita avanzar en la embriología.
Estos embriones podrían usarse para estudiar las causas de la infertilidad, el aborto espontáneo, los defectos de nacimiento y encontrar una respuesta a por qué los embriones a veces no se implantan en el útero. En el estudio no se usaron óvulos ni espermatozoides, sino células que se reprograman para reproducir los primeros días de la vida humana.
Una comprensión adecuada del desarrollo humano temprano es crucial si queremos mejorar las tecnologías de reproducción asistida y prevenir la pérdida del embarazo y los defectos de nacimiento. Sin embargo, estudiar el desarrollo temprano es un desafío: hay pocos embriones humanos disponibles y la investigación está sujeta a considerables limitaciones éticas y legales. Por tanto, la aparición de técnicas que utilizan células cultivadas in vitro para construir modelos de embriones de mamíferos abre oportunidades interesantes [(Fu, J., Warmflash, A. y Lutolf, MP Nature Mater. 20 , 132-144 (2021)].
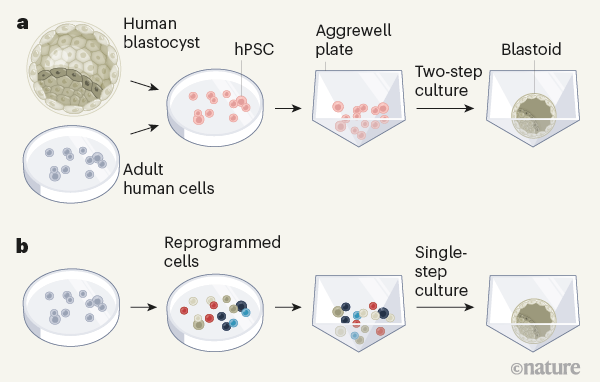
Yu y col . comenzó con células madre embrionarias humanas, que se derivan de blastocistos humanos, o células madre pluripotentes inducidas, que se generan a partir de células adultas. Es importante destacar que ambos tipos de células madre tienen un desarrollo similar a las células del epiblasto en el blastocisto y también pueden dar lugar a linajes relacionados con el trofectodermo y el hipoblasto. Por el contrario, Liu et al . reprogramaron células de piel adultas llamadas fibroblastos para formar una población celular mixta que contenía células con perfiles de expresión génica similares a los de las células del epiblasto, trofectodermo e hipoblasto. Como en los protocolos de blastoides de ratón [(Rivron, NC y col. Nature 557 , 106-111 (2018); Sozen, B. et al. Nature Cell Biol. 20 , 979–989 (2018); Li, R. y col. Cell 179 , 687–702 (2019)], ambos enfoques implicaron sembrar las células en placas de cultivo 3D llamadas placas Aggrewell y tratarlas con medio de crecimiento líquido que contenía factores químicos para controlar las actividades de señalización necesarias para el desarrollo de blastocisto (Fig. 1). Yu y sus colegas trataron las células con dos tipos diferentes de medio de cultivo en secuencia, para promover la diferenciación de las células en linajes representativos del trofectodermo y el hipoblasto.
Ambos grupos encontraron que blastoideos humanos surgieron después de 6-8 días de cultivo, con una eficiencia de formación de hasta casi un 20%, comparable a las eficiencias del ratón protocolos blastoides [(Rivron, NC y col. Nature 557 , 106-111 (2018); Sozen, B. et al. Nature Cell Biol. 20 , 979–989 (2018); Li, R. y col. Cell 179 , 687–702 (2019)]. Los blastoides humanos eran de tamaño y forma similares a los blastocistos naturales, con un número total de células similar. Contenían una cavidad y un grupo similar a ICM.
La caracterización detallada de los blastoides (incluido el análisis de expresión de todo el genoma y las comparaciones con datos de embriones humanos) mostró que sus linajes celulares comparten similitudes moleculares con los del blastocito humano antes de la implantación. La organización espacial de los linajes relacionados con epiblasto, trofectodermo e hipoblasto es coherente con la que se encuentra en los embriones humanos antes de la implantación. Los grupos también demostraron que las células blastoides tienen propiedades clave de los linajes de blastocistos: las células aisladas de los blastoides podrían usarse para generar varios tipos de células madre. Yu y col . mostró que, si estas células madre se trasplantaban en blastocistos de ratón, daban lugar a células que podrían integrarse con los linajes de ratón correspondientes en el embrión de ratón.
A continuación, los investigadores analizaron el desarrollo adicional de los blastoides utilizando un ensayo establecido que imita la implantación en el útero en placas de cultivo. Al igual que los blastocistos, cuando los blastoides se cultivaron en este ensayo durante cuatro a cinco días, algunos se adhirieron a la placa de cultivo y continuaron desarrollándose. En una parte de estos blastoides adheridos, el linaje celular representativo del epiblasto se reorganizó en una estructura que encierra una cavidad central, que recuerda a la cavidad pro-amniótica, que se forma en el epiblasto de los blastocistos posteriores a la implantación. Y en algunos blastoides, el linaje celular relacionado con el trofectodermo se extendió y mostró signos de diferenciación en tipos de células placentarias especializadas. Yu y col.. También observó una segunda cavidad en el linaje celular relacionado con hipoblastos en algunos blastoides, similar a la cavidad del saco vitelino.
Juntos, los datos de los grupos demuestran que los blastoides humanos son modelos in vitro prometedores de desarrollo de blastocistos preimplantacional y postimplantación temprano. Sin embargo, existen limitaciones notables que superar. Por ejemplo, el desarrollo de los blastoides es ineficaz y varía entre líneas celulares producidas de diferentes donantes y entre lotes experimentales. Además, los tres linajes parecen desarrollarse a ritmos ligeramente diferentes en blastoides individuales, y el desarrollo de blastoides en el mismo plato parece desincronizado. La organización espacial del linaje relacionado con hipoblasto en blastoides aún no se ha mejorado. Además, los blastoides contienen poblaciones de células no identificadas que no tienen contrapartes en los blastocistos humanos naturales.
Otro desafío es que el desarrollo de los blastoides está limitado en las etapas posteriores a la implantación, a diferencia de los blastoides de ratón. Se necesitará una mayor optimización del cultivo y las condiciones experimentales para mejorar el cultivo de blastoides humanos in vitro en la etapa posterior a la implantación , hasta el equivalente a 14 días in vivo . Las estrictas reglas éticas impiden el cultivo de embriones humanos más allá de esta etapa, cuando comienzan a aparecer las estructuras asociadas con la gastrulación. Sistemas tridimensionales para el cultivo de blastocistos humanos, que promueve eficazmente el desarrollo posterior a la implantación, podría ayudar a mejorar nuestra capacidad para cultivar blastoides hasta este límite, manteniendo la arquitectura de tejido 3D normal y las relaciones espaciales entre los diferentes linajes celulares en los blastoides.
Los científicos que realizaron tanto la investigación en la Universidad de Monash en Australia como en la Universidad de Texas en los EE UU han querido tranquilizar y justificar que estas creaciones no son réplicas reales y rechazan que se tilden de «embriones artificiales». «No siento que haya creado la vida», ha explicado en la presentación del estudio uno de los investigadores José Polo de la Universidad de Monash. «Básicamente, acabamos de crear un buen modelo», añade.
El bioquímico argentino sostiene que él está «cien por cien seguro, basándose en toda la evidencia científica, que solo pueden modelar las primeras etapas de desarrollo y, por lo tanto, no pueden convertirse en humanos». Además, varios expertos coinciden en que es necesario tener una conversación comunitaria sobre el estado de estas nuevas creaciones. ¿Qué investigación se puede realizar éticamente sobre ellas? ¿hasta dónde se puede permitir que se desarrollen?: son algunas de las cuestiones que plantean.
Los blastoides humanos son los primeros modelos de embriones humanos que se derivan de células cultivadas in vitro.y que tienen todos los linajes celulares fundadores del feto y sus tejidos de soporte. A medida que se optimizan los protocolos, estos blastoides imitarán más de cerca los blastocistos humanos. Esto conducirá inevitablemente a cuestiones bioéticas. ¿Cuál debería ser el estado ético de los blastoides humanos y cómo deberían regularse? ¿Debería aplicarse la regla de los 14 días? Estas preguntas deberán responderse antes de que la investigación sobre blastoides humanos pueda proceder con la debida precaución. Para muchas personas, el estudio de los blastoides humanos será menos desafiante éticamente que el estudio de los blastocistos humanos naturales. Sin embargo, otros podrían ver la investigación sobre blastoides humanos como un camino hacia la ingeniería de embriones humanos. Por lo tanto, el desarrollo continuo de modelos de embriones humanos, incluidos los blastoides humanos, exige conversaciones públicas sobre la importancia científica de dicha investigación.
